bài giảng 1 trang 69 SGK Hóa học 9
Viết hai phương trình hóa học với các điều kiện sau:
a) Kim loại tác dụng với oxi tạo oxit bazơ.
b) Kim loại tác dụng với phi kim tạo thành muối.
c) Kim loại tác dụng với dung dịch axit tạo thành muối và giải phóng khí hiđro.
d) Kim loại tác dụng với dung dịch muối tạo thành muối mới và kim loại mới.
Giải pháp:
a) 4na + o2 → 2na2o
2cu + o2 \( \xrightarrow[]{t^{0}}\) 2cuo
b) 2fe + 3cl2 \( \xrightarrow[]{t^{0}}\)2fecl3
2al + 3s \( \xrightarrow[]{t^{0}}\) al2s3
c) cu + 2h2so4 đặc, nóng → cuso4 + so2 + 2h2o
fe + 2hcl → fecl2 + h2
d) fe + cuso4 → cu + feso4
cu + 2agn03 2ag + cu(no3)2
bài giảng 2 trang 69 SGK Hóa học 9
Xét các cặp chất sau, cặp chất nào xảy ra phản ứng? không phản hồi?
a) nhôm và khí cl2; b) nhôm rắn, lạnh và axit nitric;
c) sắt đặc, nguội và axit sunfuric d) dung dịch fe và cu(no3)2.
Viết phương trình hóa học (nếu có).
Giải pháp:
Cặp phản ứng: al và khí cl2; fe và dung dịch cu(no3)2.
2al + 3cl2 → 2alcl3
fe + cu(no3)2 → cu + fe(no3)2
Xem Thêm: Anatomy là gì chú thích vẽ anatomy là gì
Sách giáo khoa Hóa học 9, trang 69 bài giảng thứ ba
Có các kim loại \(4\):\(a, b, c, d\) đứng sau \(mg\) trong dãy phản ứng. biết:
a) \(a\) và \(b\) phản ứng với dung dịch \(hcl\) để giải phóng khí hydro.
b) \(c\) và \(d\) không phản ứng với dung dịch \(hcl\).
c) \(b\) phản ứng với dung dịch muối của \(a\) và giải phóng \(a\).
d) \(d\) phản ứng với dung dịch muối của \(c\) và giải phóng \(c\).
Xác định thứ tự sắp xếp nào sau đây là đúng (theo thứ tự giảm dần khả năng phản ứng hóa học):
a) \(b, d, c, a\); b) \(d, a, b, c\) ;
c) \(b, a, d, c\) ; d) \(a, b, c, d\) ;
e) \(c, b, d, a\).
Giải pháp:
\(В\) đã phản ứng với muối của \(a\), và \(b\) được suy ra là hoạt động hóa học mạnh hơn \(a\).
\(d\) phản ứng với muối của \(c\), suy ra rằng \(d\) hoạt động hóa học mạnh hơn \(c\).
Vì \(a\) và \(b\) phản ứng với dung dịch \(hcl\) giải phóng hydro nên \(В, a\) đứng trước \( h \ ), \(c\) và \(d\) không phản ứng với dung dịch \(hcl\), vì vậy \(d, С\) trong \(h \ ).
Dãy kim loại trên, xếp từ trái sang phải theo thứ tự giảm dần về khả năng phản ứng hóa học là:\(В , a , d , С\)
loigiaihay.com
bài giảng 4 trang 69 SGK Hóa học 9
Viết các phương trình hóa học biểu diễn các chuyển hóa sau:
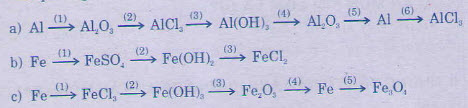
Giải pháp:
а) (1) 2a1 + o2 \( \xrightarrow[]{t^{0}}\) al2o3
(2) al2o3 + 6hcl → 2alcl3 + 3h2o
(3) alcl3 + 3naoh (vừa phải) → 3nacl + al (oh)3
(4) 2al(oh)3 \( \xrightarrow[]{t^{0}}\) al2o3+ ЗН2О
(5) 2al2o3 \( \xrightarrow[]{dpnc}\) 4al + 3o2
Xem Thêm: Jordan Là Đất Nước Nào? Vương Quốc Có Nhiều Điều Bí Ẩn
(6) 2al + 3cl2 \( \xrightarrow[]{t^{0}}\) 2alcl3
b) (1) fe + h2so4 → feso4 + h2
(2) feso4 + 2naoh → na2so4 + fe(oh)2
(3) fe(oh)2 + 2hcl → fecl2 + 2h2o
c) (1) 2fe + 3cl2 → 2fecl3
(2) fecl3 + 3naoh → 3nacl + fe(oh)3
(3) 2fe(oh)3 → fe2o3 + 3h2o
(4) fe2o3 + 3co → 2fe + 3co2
(5) 3fe + 2o2 → fe3o4
Sách giáo khoa Hóa học 9, Bài giảng 5, Trang 69
9,2 gam kim loại a phản ứng với clo dư tạo thành 23,4 gam muối. Xác định kim loại a, biết hóa trị của a là i.
Giải pháp:
\( m_{cl_{2}}\) = mmuối – mmetal = 23,4 – 9,2 – 14,2 gam hay 14,2 : 71 = 0,2 mol
Số nốt ruồi А = 2. nốt ruồi = 0,4 nốt ruồi, suy ra 0,4a = 9,2; = 23 (na).
Sách giáo khoa Hóa học 9, Bài giảng 6, Trang 69
Ngâm 2,5g lá sắt trong 25ml dung dịch cuso4 15% nồng độ 1,12g/ml. Sau khi phản ứng một thời gian, lấy lá sắt ra khỏi dung dịch, rửa nhẹ, phơi nắng, cân nặng 2,58 gam.
a) Viết phương trình hóa học.
b) Tính nồng độ phần trăm của chất trong dung dịch sau phản ứng.
Giải pháp:
* Nhận xét: “một lúc sau mới có phản hồi”, từ đó suy ra rằng cuso4 có thể vẫn còn. Gọi số mol fe đã phản ứng là x mol.
a) Công thức hóa học:
fe + cuso4 → feso4 + cu
p/u: x x x x nốt ruồi
Khối lượng lá sắt tăng = 2,58-2,5 = 0,08 gam. Ta có phương trình:
Xem Thêm: GIÁC CHÚNG SANH HỮU TÌNH – NGỘ NHẬP PHẬT TRI KIẾN
64x – 56x = 0,08
x = 0,01 nốt ruồi
b) Số mol ban đầu của cus04 \( \frac{25.1,12.15}{100.160}\) = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là feso4 0,01 mol và cuso4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = \( m_{dd cuso_{4}}\) + mfe(p.u) – mcu = 25.1.12 + 0.01.56 – 0.01.64 = 27.91 g
c%, cus04 = \( \frac{0.01625.160}{27.91}\).100% ≈ 9,32%
c%, feso4 = \( \frac{0.01.152}{27.91}\).100% ≈ 5,45%
bài giảng 7 trang 69 SGK Hóa học 9
Cho hỗn hợp nhôm và sắt có khối lượng 0,83 gam tác dụng với dung dịch axit sunfuric loãng dư. Sau phản ứng sinh ra 0,56 lít khí ở đktc.
a) Viết phương trình hóa học.
b) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Giải pháp:
Số mol khí h2 = 0,56: 22,4 = 0,025 mol.
Gọi x là số mol của al, fe.
Phương trình hóa học:
2al + 3h2so4 → al2(so4)3 + 3h2
p.u : x l,5x (mol)
fe + h2so4 -> feso4 + h2
y —> y (nốt ruồi)
Dựa vào khối lượng hỗn hợp và số mol h2 ta có hệ phương trình:
\( \left\{\begin{matrix} 27x+56y=0.83\\ 1.5x+y=0.025 \end{matrix}\right.\)
Ta có nghiệm: x = y = 0,01 = nal = nfe
%al = \( \frac{0.01.27}{0.83}\).100% = 32,53% ; %fe = 100 – 32,53 = 67,47%
giaibaitap.me


