1.1.1. thí nghiệm
- Trong SGK trình bày cách tiến hành thí nghiệm với cả điện và hóa chất như: Natri clorua khan, natri khan, sacarozơ, nước cất, dd nacl, dd nah, dd sacaroza, etanol.
- Nhưng thí nghiệm này thao tác cồng kềnh nên khi tiến hành quan sát học sinh, giáo viên thường sử dụng dụng cụ thử độ dẫn điện đơn giản như sau:
- Hiện tượng:dd nacl, hcl, naoh, … sáng lên. dd sucrose, ethanol…đừng để đèn chiếu vào
- Giải thích: Đặt máy thử độ dẫn điện vào các cốc chứa các chất khác nhau theo thứ tự. Bóng đèn sáng chứng tỏ chất trong cốc dẫn điện.
- Kết luận: Dung dịch axit, bazơ, muối đều dẫn điện
- Muối, axit, bazơ khi hòa tan trong nước sẽ phân ly thành ion khiến chúng dẫn điện.
- Điện phân là quá trình phân li các chất trong nước thành ion.
- Các chất hòa tan trong nước phân hủy thành các ion được gọi là chất điện ly.
- Chất điện ly được biểu diễn bằng pt chất điện ly: nacl → na+ + cl-
- Thí nghiệm với chất điện ly mạnh như dung dịch naah và chất điện ly yếu như ch3cooh
- Hiện tượng: Cả hai dung dịch đều làm bóng đèn sáng. Bóng đèn trong dung dịch axit axetic sáng hơn bóng đèn trong dung dịch nah
- Giải thích: Ở cùng nồng độ, nó phân ly ra nhiều ion hơn ch3cooh. Càng nhiều ion thì độ dẫn điện càng cao nên bóng đèn trong dung dịch càng sáng.
- Nhận xét: Theo mức độ phân ly của các chất điện ly khác nhau thành ion, chúng được chia thành chất điện ly mạnh và chất điện ly yếu.
- Khái niệm: Chất điện li mạnh là chất khi tan trong nước thì phân li thành ion.
- Phương trình điện phân nacl: (Lưu ý việc sử dụng mũi tên một chiều)
- Gồm:
- Axit mạnh hcl, hno3, h2so4…
- Các bazơ mạnh: naoh, koh, ba(oh)2
- Hầu hết muối.
- Ví dụ Tính nồng độ ion na+ và so42- trong dung dịch muối na2so4 0,1M
- Khái niệm: Chất điện li yếu là chất khi tan trong nước chỉ phân li một số phân tử trong phân tử tan thành ion, còn lại ở dạng phân tử. Chết trong dung dịch.
- Phương trình điện phân: (lưu ý sử dụng 2 mũi tên đối nhau)
- Ví dụ:
- Axit yếu: h2s, hclo, ch3cooh, hf, h2so3, hno2, h3po4, h2co3, …
- Bazơ yếu: mg(oh)2, bi(oh)3…
- Lưu ý: Quá trình phân ly của chất điện ly yếu là quá trình cân bằng động, tuân theo nguyên tắc bão hòa.
Dung dịch muối na2so4 là dung dịch chất điện li mạnh nên ta có phương trình ion sau:
na2so4 → 2na+ + so42-
Xem Thêm: Kinh nghiệm đi Tuyệt Tình Cốc Ninh Bình 2021
0,1m→0,2m→0,1m
Vậy nồng độ của ion na+ là 0,2m;ion so42- là 0,1m
*Chất điện li yếu:
ch3cooh \(\leftrightarrows\) ch3coo- + h+
Ví dụ trong dung dịch ch3cooh cứ 100 phân tử hòa tan thì có 2 phân tử phân ly thành ion, còn lại 98 phân tử không phân ly.
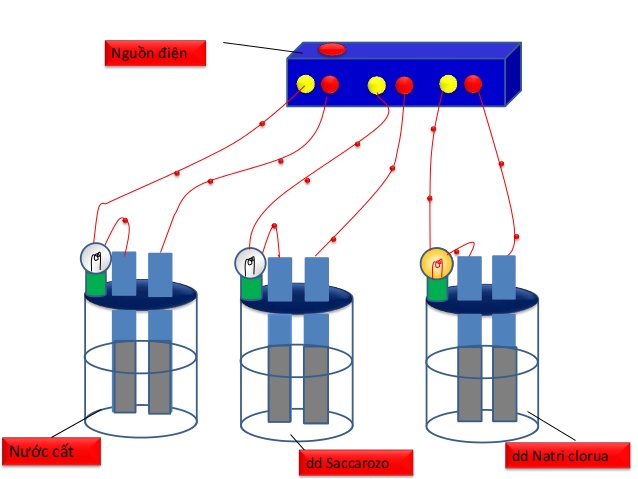
Hình 1: Bộ dụng cụ thể hiện độ dẫn điện của dung dịch
Video 1:Thí nghiệm điện phân
1.1.2. Axit, bazơ, muối dẫn điện trong nước.
hcl → h+ + cl-
Xem Thêm: Vai trò của Fun88 Genz đối với cộng đồng người chơi Fun88
naoh → na+ + oh-
1.2.1. thí nghiệm
Video 2:Tính dẫn điện của dung dịch chất điện ly mạnh
Video 3:Tính dẫn điện của dung dịch chất điện ly yếu
1.2.2. Chất điện li mạnh, chất điện li yếu
*Chất điện ly mạnh:
Xem Thêm: 6 Mẫu hội thoại đặt phòng khách sạn bằng tiếng Anh
nacl → na+ + cl-
100 hạt → 100 ion na+ và 100 ion cl-


