Sau buổi học, học viên sẽ có những hiểu biết cơ bản về tính chất hóa học của axit, làm nền tảng cho các vấn đề nghiên cứu tiếp theo sau này. p>
Giải bài tập 9 bài 3 sgk
Giải 1 Trang 14 Bài 9
Dùng mg, mgo, mg(oh)2 và dung dịch axit sunfuric loãng, viết phương trình hóa học điều chế magie sunfat.
Giải pháp thay thế:
Phương trình hóa học:
mg + h2so4(pha loãng) → mgso4 + h2
mgo + h2so4 → mgso4 + h2o
mg(oh)2 + h2so4 → mgso4 + 2h2o
Bài 9, trang 14, câu hỏi 2
Có các chất sau: cuo, mg, al2o3, fe(oh)3, fe2o3. Vui lòng chọn một trong các chất đã cho được tạo thành do phản ứng với dung dịch hcl:
a)Chất khí nhẹ hơn không khí và cháy được trong không khí.
b) Dung dịch có màu xanh lam.
c)Dung dịch có màu vàng nâu.
d)Dung dịch không màu.
Viết phương trình phản ứng.
Giải pháp thay thế:
a)Khí nhẹ hơn không khí và dễ cháy trong không khí là h2.
mg + 2hcl → mgcl2 + h2
b) Dung dịch có màu xanh lam là dung dịch cucl2.
cuo + 2hcl → cucl2 + h2o
c) Dung dịch có màu vàng nâu là dung dịch fecl3.
fe(oh)3 + 3hcl → fecl3 + 3h2o
Hoặc fe2o3 + 6hcl → 2fecl3 + 3h2o
Xem Thêm: Lớp lá mấy tuổi? Quy định tuổi đi mẫu giáo nhằm mục đích gì?
d) Dung dịch không màu là dung dịch của mgcl2 và alcl3.
al2o3 + 6hcl → 2alcl3 + 3h2o
mg + 2hcl → mgcl2 + h2
Giáo án 3 trang 14 Bài 9
Viết phương trình phản ứng cho từng trường hợp sau:
a) Magie oxit và axit nitric.
b) Đồng oxit (ii) và axit clohydric.
c) Nhôm oxit và axit sunfuric.
d) Sắt và axit clohydric.
e)Kẽm và axit sunfuric loãng.
Giải pháp thay thế:
Phương trình hóa học của phản ứng:
a) mgo + 2hno3 → mg(no3)2 + h2o
b) cuo + 2hcl → cucl2 + h2o
c) al2o3 + 3h2so4 → al2(so4)3 + 3h2o
d) fe + 2hcl → fecl2 + h2 ↑
e) zn + h2so4(mỏng) → znso4 + h2 ↑ .
Giải 4 Trang 14 Bài 9
Chứa 10 gam hỗn hợp dạng bột gồm kim loại đồng và sắt. Hãy trình bày phương pháp xác định thành phần phần trăm (theo khối lượng) của mỗi kim loại trong hỗn hợp:
a) Phương pháp hóa học. Viết phương trình hóa học.
b) Phương pháp vật lý.
(Biết rằng đồng không phản ứng với axit clohiđric và axit clohidric loãng).
Giải pháp thay thế:
Xem Thêm: Tiểu sử và sự nghiệp Vũ Văn Thanh – Cầu thủ "không phổi" của ĐTVN
a) Phương pháp hóa học:
– Ngâm hỗn hợp đồng và sắt trong dung dịch HCl dư.
– Phản ứng xong, lọc lấy chất rắn và rửa nhiều lần trên giấy lọc.
-Chất rắn được sấy khô để thu được bột đồng.
– Cân, giả sử chúng ta nặng 7,2 gam. Như vậy trong hỗn hợp có 7,2g cu và 10-7,2= 2,8g fe
⇒ %cu = (7.2/10).100% = 72% và %fe = 100% – 72% = 28%
pthh: fe + 2hcl → fecl2 + h2↑
cu + hcl → không phản ứng.
b) Phương pháp vật lý:
Sử dụng thanh từ, sau khi bọc đầu từ bằng một miếng nylon mỏng. Nhào nhiều lần hỗn hợp bột trên ta cũng được 2,8g bột fe.
Lý thuyết 9 Bài 3: Hóa học axit
I. Tính chất hóa học của axit
1. Axit sẽ làm đổi màu chất chỉ thị màu
– Dung dịch axit làm quỳ tím hóa đỏ.
Ví dụ:
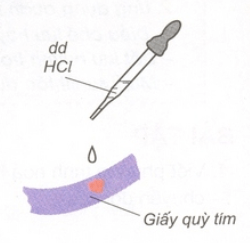
– Trong hóa học, quỳ tím là chất chỉ thị màu của dung dịch axit.
2. Axit phản ứng với kim loại
– Dung dịch axit có thể phản ứng với nhiều kim loại tạo thành muối và giải phóng khí hiđro.
Ví dụ:
3h2so4(loãng)+2al→al2(so4)3+3h2(↑)
Xem Thêm: 25 mẫu tranh 3d phong cảnh thiên nhiên tuyệt đẹp, tốt cho phong thủy
2hcl + fe → fecl2 + h2 (↑)
– Các kim loại hg, cu, ag, au, pt… không phản ứng với hcl, h2so4 loãng.
Lưu ý: Axit nitric và axit sunfuric đậm đặc sẽ phản ứng với nhiều kim loại mà không giải phóng khí hydro.
3. Phản ứng axit và bazơ:axit + bazơ → muối + nước
Ví dụ:
h2so4 + cu(oh)2 → cuso4 + 2h2o
hcl + nah → nacl + h2o
Phản ứng giữa axit và bazơ gọi là phản ứng trung hòa.
4. Phản ứng axit và oxit bazơ: axit + oxit bazơ → muối + nước
Ví dụ:
6hcl + fe2o3 → fecl3 + 3h2o
h2so4 + mgo → mgso4 + h2o
Ngoài ra, axit phản ứng với muối.
Ví dụ:
mgco3 + 2hcl → mgcl2 + co2 + h2o
na2so3 + 2hcl → 2nacl + so2 ↑ + h2o
Hai. Axit mạnh và axit yếu
Dựa vào tính chất hóa học, axit được chia thành hai loại:
+ Axit mạnh như hcl, h2so4, hno3…
+ Axit yếu như h2s, h2co3,…
►►Nhấn nút Tải xuống bên dưới để tải xuống các bài Giải Hóa Học 9Bài 3: Hóa Học Axit Trang 14 sgkFile pdf là Nó hoàn toàn miễn phí!


