Sau giờ học, học sinh sẽ tìm hiểu về đặc điểm cấu tạo, tính chất vật lý, tính chất hóa học của kim loại chế tạo. Sau đó vận dụng giải các bài tập chứng minh các hiện tượng có liên quan trong đời sống hàng ngày.
Hoàn thành bài 21/12: Điều chế kim loại
Giải bài 1 Trang 98 SGK Ngữ văn lớp 12
Đề xuất một phương pháp khả thi:
– Chế lời caco3
– điều chế cu từ cuso4
Viết phương trình hóa học của phản ứng
Giải pháp thay thế:
Điều chế canxi bằng cách điện phân nóng chảy muối halogen khan
Có thể dùng các phương pháp sau để điều chế cu từ cuso4: điện phân dung dịch, thủy luyện, nhiệt luyện.
– Thủy luyện: cuso4 + fe → feso4 + cu
– Xử lý nhiệt:
– Điện phân dung dịch:
Giải bài 2 SGK Hóa 12 Trang 98
Từ cu(oh)2, mgo, fe2o3 hãy điều chế các kim loại tương ứng bằng phương pháp thích hợp. Viết phương trình hóa học của phản ứng.
Giải pháp thay thế:
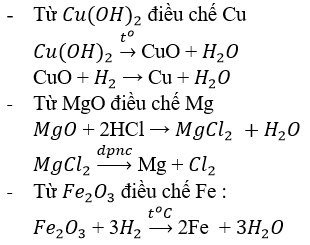
Giải bài 3 sgk 12 trang 98
Quặng sắt có 80% fe2o3 và 10% sio2. Hàm lượng nguyên tử fe, si trong quặng là:
A. 56% sắt và 4,7% silicon
54% sắt và 3,7% silicon
Xem Thêm: Tổng hợp tất cả các mẫu kết bài Tuyên ngôn độc lập hay nhất
53% sắt và 2,7% silicon
52% sắt và 4,7% silicon
Giải pháp thay thế:
Giả sử có 100 gam quặng sắt, khối lượng fe2o3 là 80 gam, khối lượng silic dioxit là 10 gam
nfe = 2 x nfe2o3 = 0,5.2 = 1(mol)
→ mfe = 1,56 = 56(g)
si giống nhau, %si = 4,7%
Câu trả lời là có.
Đáp án trang 4 SGK Ngữ văn lớp 12 năm 98
Để khử hoàn toàn 30 g hỗn hợp CuO, Feo, fe3o4, fe2o3, fe, mgo cần dùng 5,6 lít khí đkc. Khối lượng chất rắn thu được sau phản ứng là:
A. 28 gam.
26 gam.
24 gam.
22 gam.
Giải pháp thay thế:
Áp dụng định luật bảo toàn khối lượng:
30 + mco = m + mco2 → m = 30 + 0,25 x 28 – 0,25 x 44 = 26 (g)
Đáp án b.
5 Sách giáo khoa Hóa học 12 Trang 98
Điện phân (điện cực trơ) dung dịch muối sunfua của kim loại hóa trị ii với cường độ dòng điện 3a. Sau 1930 giây điện phân thấy khối lượng catot tăng 1,92 gam.
A. Viết các phương trình hóa học của các phản ứng xảy ra ở mỗi điện cực và phương trình hóa học tổng quát của quá trình điện phân.
Xem Thêm: 12 cách nói tạm biệt trong tiếng Anh
Chỉ định tên kim loại.
Giải pháp thay thế:
a) Phương trình hóa học:
b) Theo định luật Faraday, ta có khối lượng vật chất thoát ra ở các điện cực:
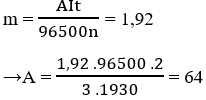
trong đó a là khối lượng nguyên tử
a = 64 a là cu
Lý thuyết 12 Bài 21: Điều chế kim loại
I. Nguyên tắc điều chế kim loại
Khử ion kim loại thành nguyên tử.
mn+ + ne → m
Hai. Phương pháp điều chế kim loại
1. Thủy luyện
Nguyên tắc: Dùng các dung dịch thích hợp như: h2so4, nah, nacn,… để hòa tan kim loại hoặc hợp chất kim loại và tách chúng ra khỏi các chất không tan có trong quặng. Sau đó các ion kim loại này bị khử trong dung dịch với các kim loại có tính khử mạnh như Fe, Zn, ….
Phạm vi ứng dụng: Thường dùng để điều chế các kim loại có tính khử yếu.
Ví dụ:
fe + cuso4 → feso4 + cu↓
fe + cu2+ → fe2+ + cu
2. Phương pháp xử lý nhiệt
Nguyên tắc: Ở nhiệt độ cao, các ion kim loại trong hợp chất bị khử bởi các chất khử như c, co, h2 hoặc các kim loại hoạt động.
Lĩnh vực ứng dụng: Công nghiệp sản xuất các kim loại có tính khử trung bình (zn, fe, sn, pb,…)
Ví dụ:
3. điện phân
Xem Thêm: Phân tích bài thơ Ông đồ của Vũ Đình Liên – Lớp 8 – Loigiaihay.com
A. Điện phân hợp chất nóng chảy
Nguyên tắc: Thông qua quá trình điện phân nóng chảy các hợp chất kim loại, các ion kim loại bị khử bởi dòng điện.
Phạm vi ứng dụng: Điều chế các kim loại hoạt động hóa học như k, na, ca, mg, al,…
Ví dụ: Điện phân nóng chảy mgcl2 để điều chế mg.
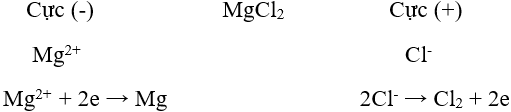
Phương trình điện phân:
b.Điện phân dung dịch
Nguyên tắc: Điện phân dung dịch muối kim loại.
Ứng dụng: Điều chế kim loại có khả năng phản ứng hóa học trung bình hoặc yếu.
Ví dụ: Điện phân dung dịch cucl2 để điều chế đồng kim loại.
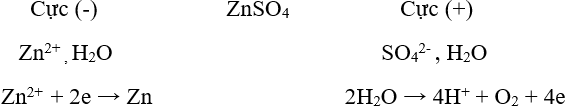
Phương trình điện phân:
Ba. Định luật Faraday
Tính lượng vật liệu thu được ở điện cực
m: khối lượng chất thu vào điện cực (g).
a: Khối lượng mol của chất ở điện cực.
n: Số lượng electron được cung cấp hoặc nhận bởi một nguyên tử hoặc ion.
i: ampe (ampe).
t: thời gian điện phân (giấy)
f: Hằng số Faraday (f = 96.500).
►►► Nhấn nút Tải xuống bên dưới ngay để tải và giải Hóa 12 Bài 21: Điều chế Kim loại sgk trang 98 word, file pdf hoàn toàn miễn phí!


