Cùng nhau luyện tập: tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng, tìm hiểu đặc điểm cấu tạo, tính chất vật lý, hóa học, vận dụng giải bài tập, chứng minh các hiện tượng liên quan trong cuộc sống hàng ngày.
Hoàn thành bài 12, bài 28: Bài tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
Giải bài 1 trang 132 sgk 12
Cho hỗn hợp gồm 3,04 gam naoh và koh phản ứng hết với dung dịch axit clohidric thu được 4,15 gam hỗn hợp muối clorua. Khối lượng hiđroxit trong hỗn hợp là:
A. 1,17 gam và 2,98 gam
1,12 gam và 1,6 gam
1,12 gam và 1,92 gam
0,8g và 2,24g
Giải pháp thay thế:
Đáp án d.
naoh + hcl → nacl + h2o
x(nốt ruồi) x(nốt ruồi)
koh + hcl → kcl + h2o
y(nốt ruồi) y(nốt ruồi)
Gọi x và y lần lượt là số mol của nah và koh
Theo đề bài ta có hệ pt
mnaoh = 0,02.40 = 0,8 (gam)
mkoh = 0,04,56 = 2,24 (g)
Giải bài 2 SGK Hóa 12 Trang 132
Sục khí 6,72 lít khí cacbonic (dktc) vào dung dịch chứa 0,25 mol ca(oh)2. Tính chất của kết tủa thu được là:
A. 10 gam.
15 gam.
20 gam.
25 gam.
Giải pháp thay thế:
Đáp án c.
Theo pt(1): nco2 = nca(oh)2 = 0,25 mol
nco2 (dư) = 0,3 – 0,25 = 0,05 (mol)
Đã xảy ra phản ứng:
Xem Thêm: Kết bài mở rộng của truyện Một người chính trực hoặc Nỗi dằn vặt
Theo pt(2): ncaco3 p = nco2 = 0,05 mol
Vậy caco3 không tan là: 0,25 – 0,05 = 0,2(mol)
Khối lượng kết tủa thu được là m = 0,2. 100 = 20 (gam)
Giải bài 3 sgk 12 trang 132
Chất nào sau đây có thể làm mềm vĩnh viễn nước cứng
A. người bán hàng.
Hydro sunfua.
na2co3.
Axit clohydric.
Giải pháp thay thế:
Đáp án c.
Giải bài 4 trang 132 sgk 12
Có 28,1 gam hỗn hợp gồm mgco3 và baco3, trong đó mgco3 là a % theo thể tích. Đem cô cạn hoàn toàn hỗn hợp trên bằng dung dịch axit clohiđric thu được co2, sau đó đun với dung dịch chứa 0,2mol ca(oh)2 thu được kết tủa b. Tính a để được lượng kết tủa lớn nhất b.
Giải pháp thay thế:
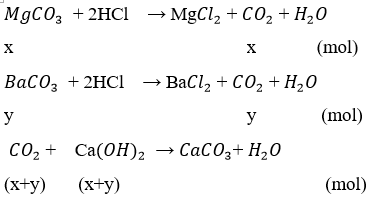
Gọi x, y lần lượt là số mol của mgco3 và baco3 trong 28,1 gam hỗn hợp.
Để lượng kết tủa caco3 thu được là lớn nhất thì số mol co2 = số mol ca(oh)2
→ x + y = 0,2
Phương pháp 1:
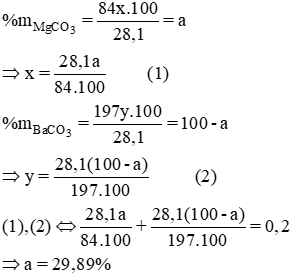
Phương pháp 2:
Giải hệ x = y = 0,1 mol
Giải bài 5 SGK Hóa 12 Trang 132
Có thể dùng chất nào sau đây để điều chế kim loại?
A. Điện phân dung dịch có màng ngăn.
Điện phân cacl2 nóng chảy.
Khử peroxit bằng nhôm ở nhiệt độ cao.
Dùng ba dung dịch cacl2 để đẩy ca ra ngoài.
Giải pháp thay thế:
Xem Thêm: Tính chất hóa học của Axit – Học tốt hóa 9 cùng Toppy – Toppy.vn
Đáp án b.
cacl2 -dpnc→ ca + cl2
Giải bài 6 sgk 12 trang 132
Sục khí co2 vào dung dịch ca(oh)2 thu được 3 gam kết tủa. Lọc tách kết tủa, sau đó đun nóng phần nước còn lại để thu thêm 2 g kết tủa nữa. Giá trị của a là:
A. 0,05 mol.
0,06 mol.
0,07 mol.
0,08 mol.
Giải pháp thay thế:
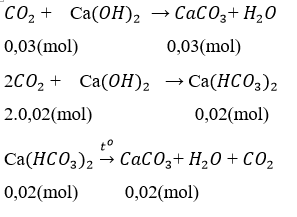
Theo pt ⇒ nca(hco3)2 = ncaco3 = 0,02 mol
Tổng số mol co2 = nco2(1) + nco2(2) = 0,03 + 2. 0,02 = 0,07 (mol)
Lý thuyết 12 Bài 28: Thực hành: Tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng
I. Kim loại kiềm và hợp chất của chúng
1. Kim loại kiềm
– Thuộc nhóm ia, đứng đầu mọi kì (trừ kì 1).
– Tính chất vật lý: Mềm, tỷ trọng thấp, nhiệt độ nóng chảy thấp.
– có 1e ở lớp ngoài cùng (ns1).
– Tính chất hóa học: Có tính khử mạnh nhất trong số tất cả các kim loại (tác dụng với nước, axit, phi kim).
m → m+ + 1e
Một số phương trình minh họa:
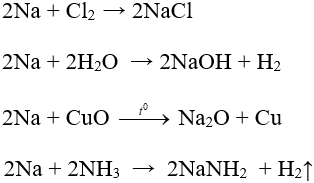
– Phương pháp điều chế: Điện phân nóng chảy hợp chất.
2. Một số hợp chất kim loại kiềm quan trọng.
– naoh: có tính kiềm mạnh; dùng để sản xuất xà phòng, thuốc nhuộm rayon, v.v.
-nahco3: lưỡng tính, bị nhiệt phân hủy, dùng được trong công nghiệp dược phẩm, thực phẩm.
-na2co3: là muối của axit yếu, được dùng trong công nghiệp thủy tinh, bột giặt, thuốc nhuộm, giấy sợi…
-kno3: chất oxi hóa mạnh khi đun nóng, dùng làm phân bón, chế tạo thuốc nổ.
Hai. Kim loại kiềm thổ và hợp chất của chúng
1. Kim loại kiềm thổ
Xem Thêm: Những bức tranh tô màu đồ ăn hấp dẫn và đáng yêu Update 11/2022
– Thuộc nhóm ia, đứng sau các nguyên tố kim loại kiềm của mỗi chu kỳ.
– Tính chất vật lý: Tương đối mềm, nhiệt độ nóng chảy thấp.
– Có 2e lớp ngoài cùng (ns2).
– Tính chất hóa học: có tính khử mạnh (tác dụng với phi kim, dung dịch axit, nước):
m → m2+ + 2e
Một số phương trình minh họa:
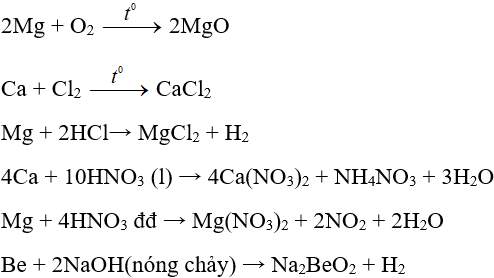
– Phương pháp cơ bản là điện phân nóng chảy muối của chúng.
cacl2 → ca + cl2↑
mgcl2 → mg + cl2↑
2. Một số hợp chất kim loại kiềm thổ quan trọng
– ca(oh)2: là bazơ mạnh, dung dịch ca(oh)2 có tính chất chung của một bazơ tan, dùng trong xây dựng, nông nghiệp và sản xuất clorua vôi.
-caco3: phân huỷ nhiệt; tan trong nước bằng co2 ở nhiệt độ thương phẩm; được sử dụng rộng rãi trong công nghiệp, xây dựng, thực phẩm,…
– ca(hco3)2: Chất lưỡng tính, bị nhiệt phân hủy.
– caso4: Theo lượng nước tinh thể trong muối, nó được chia thành ba loại.
+ caso4.2h2o (thạch cao sống): ổn định ở nhiệt độ thường, dùng để sản xuất xi măng.
+ caso4.2h2o hoặc caso4.5h2o (thạch cao nung); dùng để đúc tượng, trang trí nội thất,…
+ caso4 (anhydrit): không tan trong nước và không hoạt động.
3. Nước cứng
– Nước cứng là nước có hàm lượng ion ca2+ và mg2+ cao, nước mềm là nước có rất ít hoặc không có các ion này.
– Thể loại:
+ Nước cứng tạm thời: chứa ca(hco3)2 và mg(hco3)2.
+ Nước cứng có tính cứng vĩnh cửu: chứa các clorua và sunfat của canxi và magie.
Nước cứng có + độ cứng toàn phần: bao gồm cả tính cứng tạm thời và tính cứng vĩnh cửu.
– Các phương pháp làm mềm nước cứng: kết tủa và trao đổi ion.
Lưu ý ion hco3- trong kim loại kiềm thổ là chất lưỡng tính:
hco3- + h+ → h2o + co2
hco3- + oh- → h2o + co32-
►►► Bây giờ các em hãy nhấn vào nút Tải xuống bên dưới để tải về và Giải Hóa 12 Bài 28: Bài tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng sgk trang 132 từ, tệp pdf hoàn toàn miễn phí!


