Giải bài tập Hóa học 11 bài 35: Benzen và đồng đẳng. một số hiđrocacbon thơm khác trang 159 – 160 – 161 sgk Thông qua phần hướng dẫn giải bài tập trong SGK giúp các em ôn tập sâu những kiến thức đã học, các bài giải ngắn gọn, rõ ràng. Hỗ trợ học sinh thành công môn Hóa học lớp 11.
Giải bài tập sgk bài 11
Giải bài 1 Trang 159 SGK Bài 11
Hiđrocacbon thơm có công thức phân tử c8h10 có bao nhiêu đồng phân?
A. 2;
3
4;
5
Hãy chọn đáp án đúng
Giải pháp thay thế:
– Trả lời c
– 4 đồng phân thơm của c8h10 là:
Giải bài 2 sgk 11 trang 159
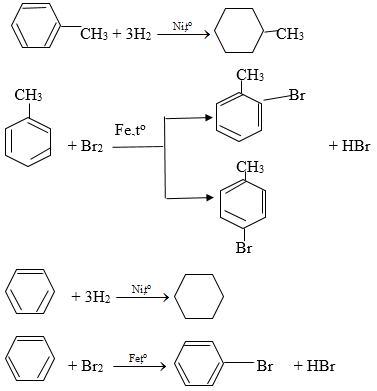
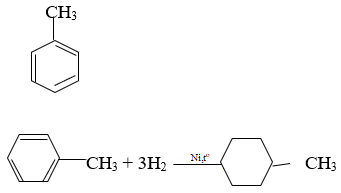
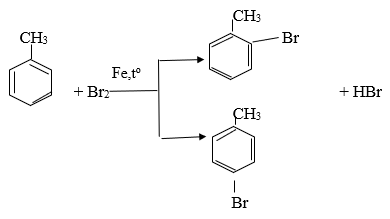
Toluen và benzen sẽ phản ứng với các chất sau: (1) Dung dịch brom trong cacbon tetraclorua; (2) Dung dịch kali pemanganat; (3) Tạo hiđro có xúc tác nitơ, đun nóng; (4) br2 có bột sắt, đun nóng được không ? Viết phương trình hóa học của phương trình xuất hiện.
Giải pháp thay thế:
Toluene và benzen phản ứng với niken để xúc tác hydro
Nung; br2 với bột sắt nung nóng
Giải bài 3 sgk trang 159 hóa học 11
Viết phương trình hóa học của các phản ứng xảy ra trong mỗi trường hợp sau:
A. Phản ứng của toluen với hiđro có xúc tác nitơ, áp suất cao, đun nóng.
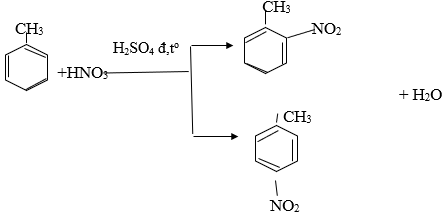
Đun nóng benzen với hỗn hợp axit nitric đặc và axit sunfuric đặc.
Giải pháp thay thế:
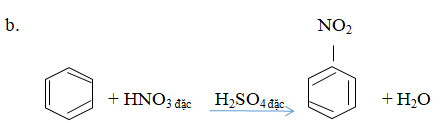
Lời giải bài 4 trang 160 SGK hóa 11
Giới thiệu phương pháp hóa học phân biệt các chất: benzen, hex-1-en, toluen. Viết các phương trình hóa học của các phản ứng đã dùng
Giải pháp thay thế:
– Cho các chất lần lượt phản ứng với dung dịch Br2, chất làm dung dịch Br2 nhạt màu hơn là hex-1-en.
– Còn 2 chất cho qua dung dịch kmno4, chất làm dung dịch kmno4 mất màu là toluen.
pthh:
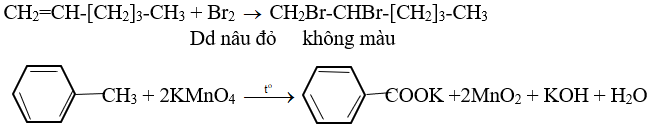
Giải bài 5 SGK Hóa 11 trang 160
Hydrocacbon x là chất lỏng có tỉ lệ khối hơi so với không khí là 3,17. Khối lượng khí cacbonic sinh ra khi đốt cháy hoàn toàn gấp 4,28 lần khối lượng nước. Ở nhiệt độ thường x không làm mất màu dung dịch brom, khi đun nóng x làm mất màu kmno4.
A. Tìm công thức phân tử và viết công thức cấu tạo của x?
Viết phương trình hóa học của phản ứng giữa x với h2 (xúc tác ni, đun nóng), brom (có mặt bột sắt), axit nitric dư và axit sunfuric đặc.
Giải pháp thay thế:
Gọi ctpt cxhy của x:
Ta có: mx = 3,17. 29 = 92 12x + y = 92 (1)
mco2 = 4,28mh2o ↔ 44x = 4,28. 18. (y/2) y = 1,14x (2)
Từ (1) và (2) ⇒ x = 7, y = 8. ctpt của x là c7h8
Tiêu đề ctct từ x là:
Xem Thêm: Tiếng Việt lớp 2 Tập đọc: Sơn Tinh, Thủy Tinh – VietJack.com
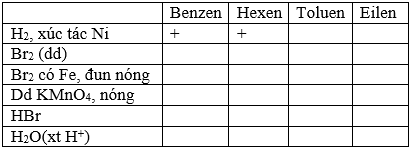
Giải bài tập hóa học lớp 11 trang 160
Đánh dấu (+) vào ô ghép cặp các chất phản ứng với nhau theo mẫu sau:
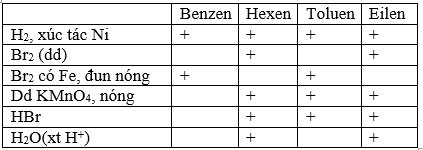
Giải pháp thay thế:
Giải bài tập trang 160 môn Hóa học lớp 7
Dưới tác dụng của chất xúc tác axit sunfuric đặc, cho benzen phản ứng với axit nitric đặc dư tạo ra nitrobenzen. Tính khối lượng nitrobenzen thu được từ 1,00 tấn benzen với hiệu suất 78,0%.
Giải pháp thay thế:
Phương trình phản ứng:
Vì h=78% nên khối lượng nitrobenzen thu được là:
Giải bài tập Hóa lớp 8 11 trang 160 sgk
So sánh tính chất hóa học của etylbenzen và styren, viết phương trình hóa học của phản ứng minh họa.
Giải pháp thay thế:
A. Giống nhau: tất cả đều phản ứng như thế này
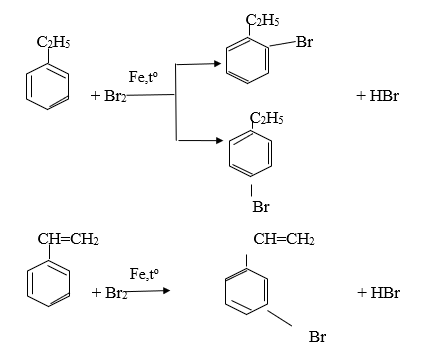
Khác:
Etylbenzen có tính chất giống ankan
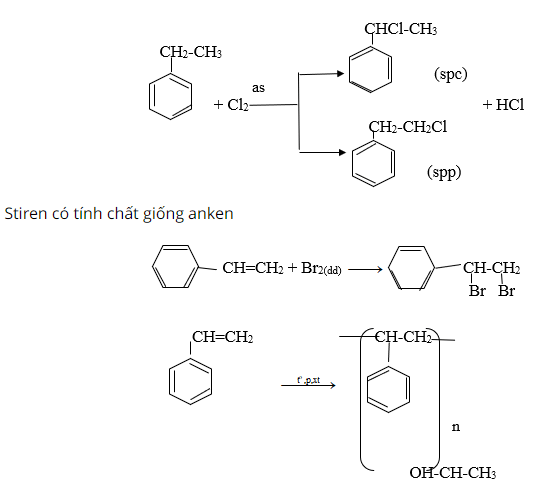
Giải bài 9 trang 160 sgk hóa học lớp 11
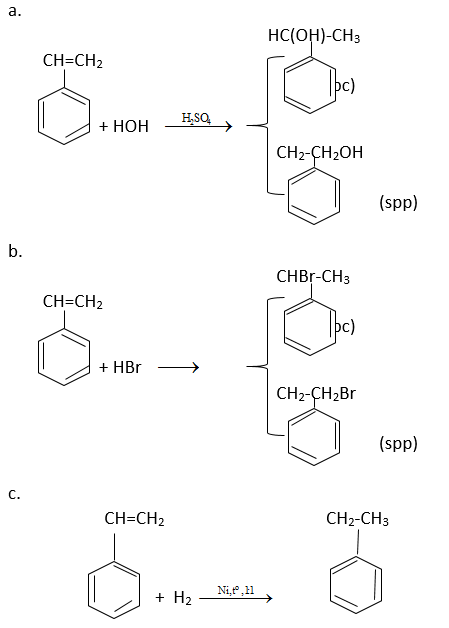
Viết phương trình hóa học của styren theo công thức cấu tạo:
A. h2o (xúc tác h2so4)
h2 (tỉ lệ mol 1:1, xúc tác ni)
Giải pháp thay thế:
SGK 11 Hóa học 10 trang 160
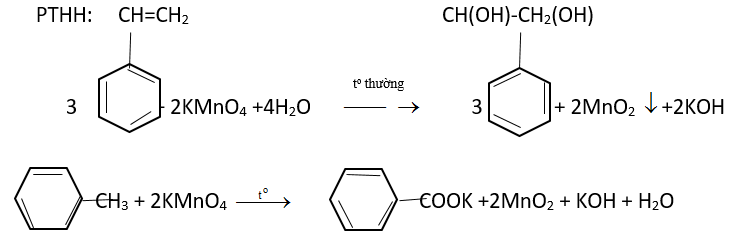
Hãy đề xuất phương pháp hóa học để phân biệt 3 chất lỏng sau: toluen, benzen và styren. Viết các phương trình hóa học của các phản ứng hóa học đã dùng.
Giải pháp thay thế:
– 3 chất lỏng phản ứng với dung dịch kmno4 ở nhiệt độ thường, và chính styren làm đổi màu dung dịch kmno4 ở nhiệt độ thường.
– Đối với 2 hỗn hợp phản ứng còn lại ta đun nóng thì chất làm mất màu dung dịch kmno4 (nóng) là toluen còn lại là benzen.
Giải bài 11 Hóa học trang 160 SGK Hóa 11
Sau khi dehiđro hóa 66,25kg etylbenzen thì thu được 52,00kg styren. Tất cả các styren này đều được trùng hợp để thu được hỗn hợp polystyren và một phần styren không phản ứng. Biết rằng 5,20 g a đủ làm mất màu 60,00 mL dung dịch brom 0,15M.
A. Tính hiệu suất của phản ứng tách hiđro của etylbenzen.
Tính khối lượng styren đã trùng hợp.
Polyene có khối lượng phân tử trung bình là 3,12.105. Tính hệ số trung bình cộng gộp.
Giải pháp thay thế:
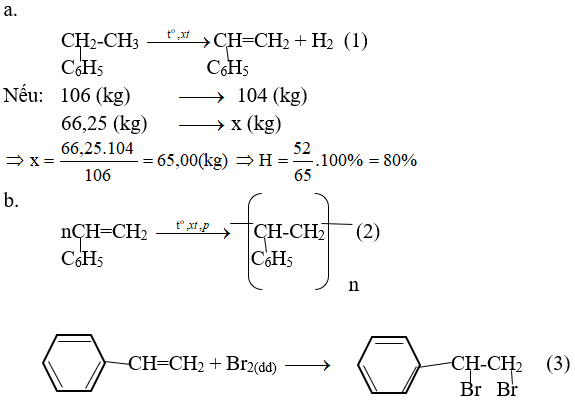
nbr2 = 0,06.0,15 = 0,009(mol)
Theo định luật bảo toàn khối lượng: ma = msriren = 52,00(kg) = 52.103(g)
Theo chuyên đề: 5,2 g a vừa đủ với 0,009 mol Br2
52.103g a với 90 mol br2 là đủ
Theo (3): nstiren = nbr2 = 90(mol)
Xem Thêm: Tóm tắt trận đánh giữa Đăm Săn và Mtao Mxây (3 Mẫu) – Văn 10
mstiren = 90,104 = 9360(g) = 9,36(kg)
Khối lượng styren tham gia phản ứng trùng hợp=ma – mstiren = 52 – 9,36 = 42,64 (kg)
Hệ số trùng khớp là:
Giải bài 12 SGK Hóa học Trang 161 lớp 11
Trình bày một phương pháp đơn giản để thu được naphtalen tinh khiết từ hỗn hợp naphtalen có chứa các tạp chất không tan trong nước và không bay hơi.
Giải pháp thay thế:
Đậy miệng phễu bằng giấy đục lỗ, dán hỗn hợp naphtalen và tạp chất lên đó, đun nóng (dụng cụ lắp đặt như hình 7.3/SGK trang 157), naphtalen thăng hoa tạo thành tinh thể hình kim bám chặt vào bề mặt của tờ giấy, và chúng ta thu được naphtalen tinh khiết.
Giải bài 13 SGK Hóa học Trang 161 lớp 11
Tổng hợp styren từ etilen và benzen theo sơ đồ:
A. Viết phương trình hóa học thực hiện chuyển hóa trên?
Nếu hiệu suất của quá trình là 78%, hãy tính khối lượng styren thu được từ 1,00 tấn benzen.
Giải pháp thay thế:
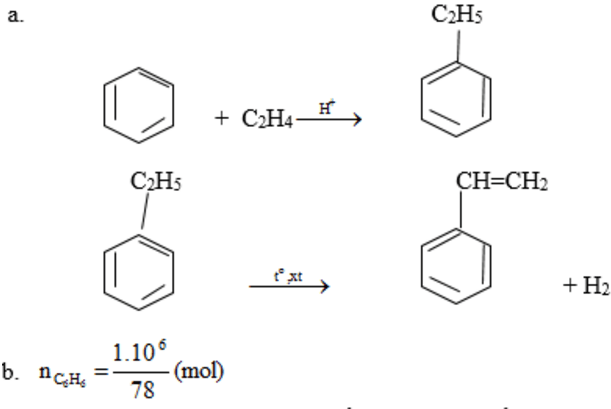
Theo phương trình phản ứng: nstiren = nbenzen
Nhưng do hiệu suất=78.00%
⇒Khối lượng styren=1.104.104(g)=1,04(tấn)
Lý thuyết 11 Bài 35: Benzen và đồng loại – Một số chất thơm khác
I. Cấu trúc, tương đồng, không đồng nhất và đặt tên
1. bình đẳng, cơ cấu
– Công thức tổng quát: cnh2n-6 (n 6).
– Tên thường gọi là are.
– Công thức phân tử đơn giản nhất là benzen (c6h6).
– Các ankylbenzen phổ biến là toluen c6h5ch3, xylen c6h4(ch3)2, cumen c6h5ch(ch3)2, …
– Công thức cấu tạo: Phân tử benzen được cấu tạo bởi 6 nguyên tử h và 6 nguyên tử c nằm trên cùng một mặt phẳng, trong đó 6 nguyên tử c tạo thành một lục giác đều, mỗi nguyên tử c liên kết với một nguyên tử h. Độ dài liên kết c-c là như nhau và độ dài liên kết c-h là như nhau.
– Vậy công thức cấu tạo của benzen được biểu diễn như sau:
*Hương liệu:
+ Khi tách 1h khỏi phân tử benzen thu được nhóm phenyl (c6h5-)
+ Trừ đi 1h ở nguyên tử cacbon trên vòng benzen của phân tử hiđrocacbon thơm thu được nhóm aryl.
+ Tách trong 2 giờ thu được phenylen và arylen.
2. Tính không đồng nhất, đặt tên
A. đồng phân
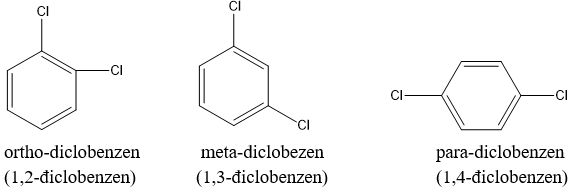
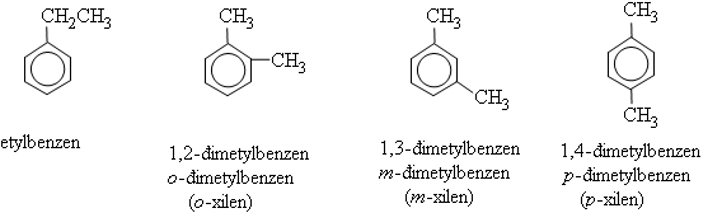
Vì liên kết c-c trong vòng benzen giống nhau nên benzen chỉ có 3 đồng phân vị trí:
+ Nếu 2 nhóm thế ở 2 chữ c liền nhau ta có đồng phân ortho (viết tắt là o-) hoặc được đánh số 1,2.
+ Nếu 2 nhóm thế cách nhau 1 nguyên tử cacbon (đỉnh thứ nhất của tam giác) thì gọi là đồng phân meta (viết tắt là m-) hay 1,3.
+ Nếu có 2 nhóm thế ở 2 nguyên tử cacbon trái dấu gọi là đồng phân para (viết tắt là p-) hay 1,4.
Ví dụ: Đồng phân dichlorobenzene (c6h4cl2).
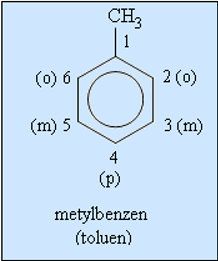
b. Danh pháp
– Khi coi vòng benzen là mạch chính thì nhóm alkyl gắn vào nó sẽ phân nhánh (còn gọi là nhóm thế).
– Ankylbenzen có đồng phân mạch cacbon. Để đặt tên cho chúng, vị trí của nguyên tử c trong vòng phải được biểu thị bằng một số hoặc bằng các chữ cái o, m, p (phát âm là ortho, meta, para). Chi tiết như sau:
Xem Thêm: Cây dừa xanh tỏa nhiều tàu dang tay đón gió gật đầu gọi trăng thân
Ví dụ:
Hai. Thuộc tính vật lý
– Benzen là chất lỏng không màu, có mùi thơm đặc trưng, nhẹ hơn nước, không tan trong nước, tan trong các dung môi hữu cơ như ancol, ete, xeton.
Ba. Tính chất hóa học
1. Phản ứng như vậy
c6h6 + br2 → c6h5br + hbr (fe, tº)
c6h6 + hno3 → c6h5no2 + h2o (h2so4 đặc, tº)
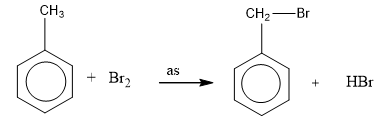
– Do ảnh hưởng của vòng thơm trên mạch nhánh, toluen tham gia phản ứng thế nguyên tử hiđro của nhóm ch3 dưới ánh sáng
– Toluen dễ tham gia phản ứng brom hóa trên vòng dưới xúc tác của bột sắt, tạo thành hỗn hợp hai đồng phân:
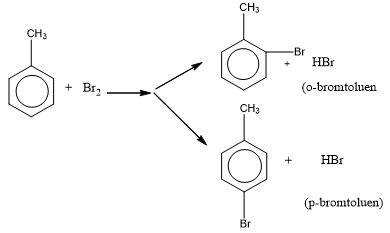
– Quy tắc thế vòng benzen:
+ Nếu trong vòng benzen đã có sẵn nhóm thế loại i (-oh, ankyl, -nh2, …) thì phản ứng thế xảy ra dễ dàng hơn benzen và nghiêng về vị trí o- .strong> và p-.
+ Nếu trong vòng benzen đã có nhóm thế loại ii (-cooh, -cho, -ch=ch2) thì phản ứng thế diễn ra khó hơn đối với benzen và nghiêng về vị trí m-.
2. Phản ứng cộng
3. Phản ứng oxi hóa
– Benzen không làm mất màu dung dịch kmno4.
– phenylalkyl, khi đun nóng với kmno4 chỉ có ankyl bị oxi hóa.
c6h5-ch3 + 2kmno4 → c6h5cook + 2mno2 + koh + h2o
– Bị oxi hóa hoàn toàn:
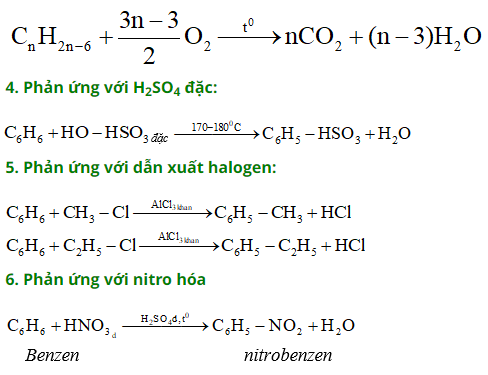
Bốn. Ứng dụng và điều chế
1. Áp dụng
– Tổng hợp monome của polyme dùng trong sản xuất nhựa, cao su và sợi tơ tằm (ví dụ: polystyren, cao su nitrile, acrylon).
– Từ benzen người ta điều chế nitrobenzen, anilin, phenol để tổng hợp thuốc nhuộm, thuốc, thuốc trừ sâu…
– Toluene được dùng trong sản xuất thuốc nổ tnt (trinitrotoluene).
– Benzen, toluen và xylen cũng được sử dụng rộng rãi làm dung môi.
2. điều chế
– Benzen được sản xuất từ axetilen:
3c2h2 → c6h6 (c, 600ºc)
– Tách hydro từ xiclohexan:
c6h12 → c6h6 + 3h2 (tº, xt)
– Etylbenzen được sản xuất từ benzen và etilen:
c6h6 + ch2=ch2 → c6h5ch2ch3 (tº, xt)
►►Nhấp vào nút Tải xuống bên dưới để tải xuống các bài Giải Hóa Học Bài 11, Bài 35: Benzen Và Các Đồng Chất. Một số chất thơm khác trang 159, 160, 161 sgk file pdf hoàn toàn miễn phí!


